Más allá de la luminiscencia: NanoLuc en el estudio del cáncer
La bioluminiscencia se ha posicionado como una herramienta de vanguardia en el estudio del cáncer al adaptarse a evaluar la complejidad de la enfermedad de manera precisa a través de los procesos alterados o hallmarks que la caracterizan, por ejemplo a través de; ensayos reporteros y vías de señalización, cuantificación de metabolitos, estrés oxidativo, muerte celular, viabilidad, respuesta inmunológica, entre otros.
Si bien la luciferasa convencional de Renilla es altamente sensible y ofrece la ventaja de menor ruido a comparación de un método basado en fluorescencia, Promega ha desarrollado un enizma aún más sensible y potente: Nanoluc. Esta enzima es derivada del camarón Oplophorus gracilirostris, y consiste en una proteína de 19.5 kDa, 100 veces más potente que la luciferasa convencional de Renilla, y con una cinética más estable. Además, ente es mucho menor en tamaño y no requiere ATP, lo que la hace no solo más eficiente frente a los ensayos reporteros que utilizan otra luciferasa. Dadas estas características, la tecnología NanoLuc permite aplicaciones desde el screening de compuestos, interacciones moleculares, imagenología in vivo con bioluminiscencia, y más. Para el desarrollo de estas aplicaciones, se desarrollaron dos tecnologías basadas en la enzima NanoLuc: NanoBRET y NanoBiT.
El método NanoBRET (Bioluminescence Resonance Energy Transfer) consiste en fusionar proteínas de interés con la luciferasa basado en la transferencia de energía entre ellas, lo que proporciona información invaluable sobre la proximidad y la afinidad entre las moléculas en estudio. Esta técnica ha demostrado ser especialmente útil en el estudio de interacciones proteína-proteína, así como en la caracterización de ligandos y su unión a receptores celulares.
Por otro lado, el sistema NanoBiT (NanoLuc Binary Technology) ofrece una plataforma que utiliza un fragmento pequeño (Small BiT) y otro grande (Large BiT) que, al unirse específicamente, restauran la actividad bioluminiscente. Esta técnica, además de su sensibilidad y versatilidad, destaca por su capacidad para realizar ensayos en tiempo real y en condiciones fisiológicas, lo que la convierte en una herramienta invaluable para el estudio de procesos biológicos dinámicos.
En el estudio del cáncer, estas aplicaciones son herramientas versátiles que permiten evaluar procesos dinámicos y en tiempo real, con alta sensibilidad, reproducibilidad , y por consiguiente resultados confiables que nos permitan avanzar en nuestra investigación. Por ejemplo:
 |
Interacciones Proteínas-Proteínas |
Los ensayos NanoBRET PPI Interaction es un sistema basado en el método de NanoBRET para determinar interacciones entre proteínas en donde la luciferasa NanoLuc es el donador de energía y una proteína HaloTag tiene el fluoroforo aceptor. Las proteínas de interés se fusionan a cada uno de los componentes para evaluar la interacción, y, por consiguiente, de haber interacción no hay BRET y por lo tanto se emite luminiscencia. Para realizar la fusión, se puede elegir entre el sistema de Multi Cloning Site para generar las proteínas fusionadas N y C terminal o bien, elegir el sistema basado en Flexi Vector Cloning.
 |
Imagenología con bioluminiscencia |
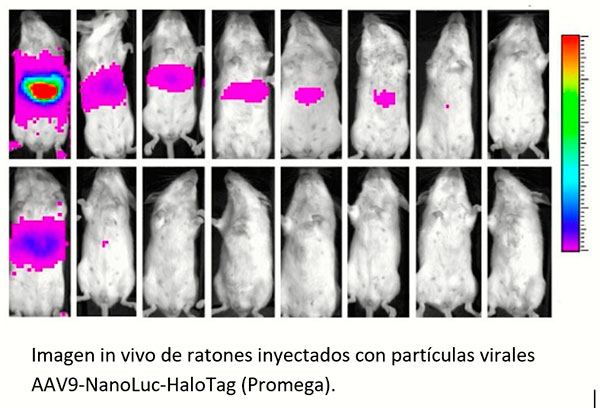 El Sustrato in vivo Nano-glo Fluorofurimazine (FFz9) (Cat. No: N4100) es un reactivo optimizado para la detección in vivo de la luciferasa NanoLuc, proteínas fusionadas con NanoLuc, o la luciferasa NanoBiT reconstituida. El reactivo es soluble en agua y permite la detección in vivo con biodisponibilidad, señales estales y opciones flexibles de entrega. Ideal para el análisis de distribución viral, seguimiento de células CAR T, exosomas, ontogenética, ensayos de luciferasa in vivo, entre otros.
El Sustrato in vivo Nano-glo Fluorofurimazine (FFz9) (Cat. No: N4100) es un reactivo optimizado para la detección in vivo de la luciferasa NanoLuc, proteínas fusionadas con NanoLuc, o la luciferasa NanoBiT reconstituida. El reactivo es soluble en agua y permite la detección in vivo con biodisponibilidad, señales estales y opciones flexibles de entrega. Ideal para el análisis de distribución viral, seguimiento de células CAR T, exosomas, ontogenética, ensayos de luciferasa in vivo, entre otros.
 |
Virus reporteros |
Ingresar un gen reportero a un virus supone muchas dificultades por el tamaño del inserto, por ejemplo: todos los genes del virus son críticos in vivo, el genoma no es apto para largas inserciones, las inserciones pueden atenuar la replicación, las inserciones al final de regiones codificantes pueden evitar el empaquetamiento. Es por ello, que NanoLuc resuelve estos problemas gracias a su pequeño tamaño con respecto a los demás reporteros. Además, aplicaciones del NanoBiT han sido de utilidad como marcadores de proteínas bioluminiscentes, las cuales pueden ser reconocidas por tres reactivos: Nano-Glo® HiBiT Lytic Detection System, Nano-Glo® HiBiT Extracellular Detection System, y Nano-Glo® HiBiT Blotting System, para detección en Western Blots.
 |
Interacciones GPCR |
Los ensayos NanoBiT permiten evaluar interacciones entre los receptores acoplados a proteínas G (GPCR, por sus sigas en inglés). Estos receptores son una familia importante d proteínas con un papel crucial en la señalización celular, lo cuales están implicados en cáncer (angiogénesis, metástasis, proliferación, etc.). En este contexto la tecnología NanoBiT permite estudiar las interacciones de estos receptores y sus proteínas asociadas como G, quinasas y arrestinas. Estas interacciones en losen tiempo real e in vivo, son fundamentales para comprender los mecanismo subyacentes de la señalización de GPCR en células tumorales, así como para identificar nuevo blancos terapéuticos.
 |
Reporteros Genéticos |
Los ensayos reporteros de luciferasa suelen utilizarse para evaluar actividad promotora, splicing, traducción y regulación de microRNAs. Si bien, con la enzima NanoLuc todas estas aplicaciones se ven optimizadas por las ventajas que ofrece, desde su tamaño hasta la intensidad de la señan, ahora su aplicación puede ir más lejos. Por ejemplo, ingresar el gen reportero mediante CRISPR para evaluar como responde a un gen a condiciones particulares o un compuesto. Además, de ser de gran utilidad para evaluar regiones de interacción y promotoras predichas con análisis bioinformáticos e inteligencia artificial.
 |
Afinidad compuestos |
Los ensayos de afinidad de compuestos tienen el propósito de evaluar la interacción o unión de un compuesto químico con su proteína blanco en un sistema vivo. Por ejemplo, en el proceso del desarrollo de fármacos, incluida la validación del blanco, el establecimiento de relaciones estructura-actividad y la confirmación del mecanismo de acción. Para ello, estos ensayos se basan en la tecnología NanoBRET™, específicamente, la proteína blanco expresa la luciferasa NanoLuc fusión. Minetas que un tracer fluorescente y permeable de NanoBRET se une a la proteína de interés. Cuando el tracer se une a la proteína de fusión en células vivas, el tracer estará en proximidad a la luciferasa y resultará en una señal de BRET. De esta manera, los compuestos a evaluar competirán por la unión a la proteína generando la pérdida de la señal de BRET.
